全球肿瘤免疫治疗发展现状及趋势分析报告
肿瘤免疫治疗是指通过激活或者增强人体免疫系统来对抗肿瘤的治疗方法,主要通过重启并维持肿瘤-免疫循环来恢复机体正常的抗肿瘤免疫反应。肿瘤免疫治疗具有划时代的意义,近年来涌现出来两类代表性的肿瘤免疫药物:PD-1/PD-L1 药物和 CAR-T 疗法,PD-1/PD-L1 是免疫治疗皇冠上的明珠,目前正处于发展黄金期,覆盖了数十种肿瘤适应症,其中 K 药更是首次被批准用于广谱癌症,2018 年全球 PD-1/PD-L1 单抗销售额约为 162.6 亿美元,同比增长 66%,未来有望成为全球销售额最大的药品品类,并且预计未来PD-1/PD-L1 抗体药物将通过联合用药成为各肿瘤适应症一线治疗方案。CAR-T 疗法是通过经嵌合抗原受体修饰的 T 细胞特异性识别和结合肿瘤相关抗原,实现对肿瘤细胞的特异性杀伤。由于 CAR-T 细胞目前只能使用自体 T 细胞进行扩增,因此又被称为私人订制疗法,目前全球一共上市两款 CAR-T 疗法,国内复星的益基利仑赛注射液是首家获得上市受理的 CAR-T 疗法,目前获批的 CAR-T 疗法均是针对血液瘤,由于实体瘤没有足够筛选到足够特异性的抗原因此进展缓慢,但未来实体瘤一定是 CAR-T 的最终市场,一旦攻克会给 CAR-T技术带来更广阔的市场空间,能使 CAR-T 治疗真正从早期走向通用,真正发挥“私人订制”的价值。
一、肿瘤免疫治疗
现代抗癌药物发展至今历经三次革命:(1)第一次是“化疗药物”出现,通过杀死快速分裂的细胞来抑制肿瘤细胞生长,但同样损伤正常细胞,副作用严重;(2)第二次革命是靶向药物面世,选择性杀死肿瘤细胞且不影响正常细胞,但肿瘤细胞容易出现抗药性,导致复发率高;
(3)第三次革命是免疫疗法,革命性体现在通过激活或者增强人体免疫系统来对抗肿瘤,不直接针对肿瘤细胞,免疫疗法可以治疗多种癌症且复发率低,曾被顶级学术杂志评为最佳科学突破。
正常情况下人体免疫系统可以识别并清除肿瘤细胞,但肿瘤细胞具有“免疫逃逸”机制,即通过多种机制逃避免疫系统识别和攻击,使其不能被正常清除,从而在抗肿瘤免疫应答的各阶段得以幸存。因此肿瘤免疫治疗就是通过重启并维持肿瘤-免疫循环来恢复机体正常抗肿瘤免疫反应,从而达到控制与清除肿瘤的目的。
广义上的肿瘤免疫治疗包括免疫检查点抑制剂、治疗性抗体、癌症疫苗、细胞治疗和小分子抑制剂和免疫系统调节剂等,目前所说的肿瘤免疫治疗通常是指近年来有飞速突破的免疫检查点抑制剂及 CAR-T 治疗免疫检查点抑制剂中代表性药物主要是 PD-1/PD-L1;CAR-T 即嵌合抗原受体 T 细胞免疫疗法,为新型精准靶向疗法,近几年通过优化改良治疗肿瘤效果良好,当前多用于血液瘤治疗,是有可能治愈癌症的新型肿瘤免疫治疗方法。
二、PD-1/PD-L1 药物,免疫治疗
抗程序性死亡蛋白 1(programmed death 1, PD-1)抗体是目前研究最多、临床发展最快的免疫疗法。PD-1主要表达于活化的 T 细胞和 B 细胞中,有两个配体分别是 PD-L1 和 PD-L2,PD-L1 在多种组织中有表达,PD-1与 PD-L1 结合会抑制 T 细胞对肿瘤细胞杀伤功能,对人体免疫应答起负调节作用。肿瘤微环境会诱导浸润 T细胞高表达 PD-1,肿瘤细胞则会高表达配体 PD-L1 和 PD-L2,导致 PD-1 通路持续激活,T 细胞功能被抑制,无法杀伤肿瘤细胞。PD-1/PD-L1 抑制剂可以阻断这一通路,恢复 T 细胞对肿瘤识别功能,使 T 细胞能够继续杀伤肿瘤细胞,从而实现自身免疫系统的抗癌作用。
自从全球首个 PD-1 单抗 Opdivo 于 2014 年 7 月在日本上市以来,全球 PD-1/PD-L1 市场持续快速增长,2018年全球 PD-1/PD-L1 单抗销售额约为 162.6 亿美元,同比增长 66%,未来有望成为全球销售额最大的药品品类。美国花旗集团预测 PD-1/PD-L1 抗体在 2020 年全球市场规模将达到 350 亿美元,此外全球主要研究机构如Global Data、Global Business 等对 PD-1/PD-L1 市场空间的预期也一再拔高,体现了行业对新免疫治疗药物以及新适应症获批后销售额上升的乐观预期,过去肿瘤药物的传统增速已经不能满足免疫药物巨大市场潜力的爆发,预计未来全球 PD-1/PD-L1 市场有望超过 500 亿美元。
单抗药物适应症拓展主要体现在两个方面:新适应症的开辟以及同一适应症后线治疗的前移。以 O 药和 K 药为例,Opvido 和 Keytruda 均是 2014 年获批,2019 年 K 药销售额大幅超过 O 药,且增速也远超 O 药,主要是由于:(1)O 药获批适应症数量少于 K 药,且自 2017 年后 K 药获批适应症逐步增多,有力支撑后续增速。(2)肺癌一直是肿瘤领域中的重要市场,Opdivo 一线治疗非小细胞肺癌(NSCLC)失利,而 Keytruda 临床试验数据优异,2018 年 10 月底获批 NSCLC 一线治疗,更加拉开两者差距。
2015-2019年Opvido全球销售额
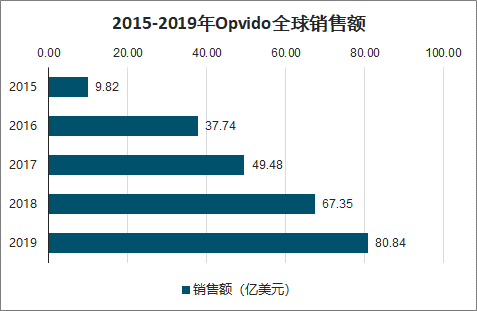
数据来源:公开资料整理
2015-2019年Keytruda全球销售额

数据来源:公开资料整理
2014-2019Opdivo 、Keytruda 经FDA批准适应症数量
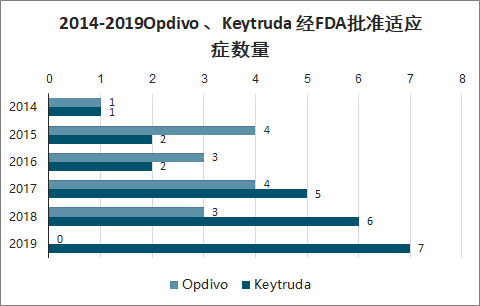
数据来源:公开资料整理
我国肿瘤市场空间巨大,国内外众多药企均早已布局 PD-1/PD-L1 单抗,目前国内已经上市 8 款 PD-1/PD-L1 单抗,默沙东 K 药目前获批 2 个瘤种(非小细胞肺癌、黑色素瘤,共 4 个适应症),BMS 的 O 药已获批非小细胞肺癌和头颈部鳞状细胞癌,阿斯利康 Imfinzi获批非小细胞肺癌,阿替丽珠单抗获批一线小细胞肺癌,另外国产四大 PD-1 单抗(特普瑞利、信迪利、卡瑞丽珠和替雷丽珠)中除特普瑞利获批黑色素瘤,其余三家均是获批霍奇金淋巴瘤,可以看出国产和进口企业获批适应症重合性较低,一方面是为了避免上市之初就头对头的激烈竞争,另一方面是国产企业纷纷采取“先上市小适应症,再扩充大适应症”的策略,此外八大 PD-1/PD-L1 单抗均有布局非小细胞肺癌,此外其他布局较多的适应症有小细胞肺癌、肝癌、胃癌等,均为我国发病率排名前五的癌症,可见未来在大适应症方面会迎来比较激烈的市场竞争,此外国内企业也在布局多项其他适应症如鼻咽癌、淋巴瘤、实体瘤等并取得积极进展,这些适应症暂时没有海外产品参与竞争,如若未来顺利获批国内 PD-1/PD-L1 单抗的市场空间也将得到持续提升。
除拓宽适应症外, PD-1/PD-L1 市场定价策略也是影响产品渗透率和市场空间的关键因素。PD-1/PD-L1 国内市场价格竞争较为激烈,目前 BMS 和默沙东的 PD-1 定价均只有美国定价的一半,几乎是全球最低价,国产拓益和达伯舒价格更低,此外医保对于创新药价格预期也较为超过厂家预计,医保更多是从药物经济学的角度及本国国民的实际经济承受能力来考虑对创新药的定价,对于所谓企业方全球价格体系的维护并不做太多考虑,在 2019 年医保谈判后,只有信达宣布达伯舒 100mg/10ml:2843元价格进入医保,其他同类单抗并未满足医保降价服务要求,但是跨国企业也有其他的办法来继续竞争市场,如迅速降低援助门槛。
PD-1/PD-L1 药物缺陷在于单药应答率不高,平均应答率不到 30%,但 PD-1/PD-L1 药物免疫逃逸通路众多,可以与其他肿瘤治疗药物联合用药提高应答率,扩大临床适应症和受益人群比例,这也是近年来市场预期不断提高的原因,预计未来 PD-1/PD-L1 抗体药物将通过联合用药成为各肿瘤适应症一线治疗方案。目前全球PD-1/PD-L1 单抗药物的临床试验仍在快速增加,已从单一疗法向联合疗法转变,有 76%活跃临床试验显示PD-1/PD-L1 单抗药物与其他癌症疗法的联合治疗,包括与肿瘤免疫疗法、靶向疗法、化疗或放射疗法等联用,最常见的三种组合疗法分别是:化疗,CTLA-4 抗体和靶向 VEGF 联用。
各大癌种一线疗法上基本都是同化疗联合治疗,如替雷丽珠单抗联合顺铂或卡铂和吉西他滨治疗尿路上皮癌;联合索拉非尼治疗肝细胞癌;联合铂类药物与培美曲塞治疗非小细胞肺癌、联合紫杉醇+卡铂或联合白蛋白-紫杉醇+卡铂治疗鳞状非小细胞肺癌、联合铂类药物和依托泊苷治疗小细胞肺癌等已进入三期临床试验。
三、CAR-T :肿瘤免疫治疗新星,真正的“ 私人订制”
CAR-T 是 Chimeric Antigen Receptor T-Cell Therapy(嵌合抗原受体 T 细胞疗法)的简称,是通过经嵌合抗原受体修饰的 T 细胞特异性识别和结合肿瘤相关抗原,实现对肿瘤细胞的特异性杀伤。CARs 是由 T 细胞受体(TCR)胞内信号区、跨膜区及胞外抗原结合区组成,胞外区具有识别特定肿瘤抗原的功能,这种 CARs 转染 T 细胞具有抗体特异性和效应 T 细胞的细胞毒作用。CARs 一旦与 TAA(肿瘤抗原)结合,可通过胞内信号区使 T 细胞活化发挥作用,表现为 CARs 依赖的杀伤、增殖及细胞因子释放。
CARs的结构示意图
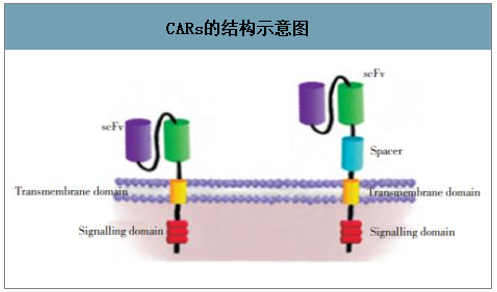
数据来源:公开资料整理
由于异体 T细胞输入极易引起人体免疫排斥反应,因此 CAR- -T治疗目前只能采用患者自身T细胞,属于真正的 “ 私人订制 ”。大致治疗过程可以分为五步:(1)从肿瘤患者 PBMC 中分离纯化出 T 细胞;(2)抗 CD3 和抗 CD28 抗体刺激 T 细胞激活;(3)利用基因工程将识别肿瘤抗原的 CARs 结构转入 T 细胞;(4)体外培养并大量扩增 CAR-T 细胞至治疗所需剂量,一般为十亿至百亿级别;(5)化疗清淋预处理后回输 CAR-T 细胞,观察疗效并严密监测不良反应。
当前CAR- -T结构发展已经历四代。每一代 CAR-T 结构都是在胞内区添加更多的组件进行修饰,使其更精准、更高效、更持久。第一代 CAR-T 细胞主要解决靶向问题,但缺少完全共刺激信号,无法完全激活T 细胞,导致其在体内扩增不良;第二代 CAR-T 在 CAR 结构上加上共刺激结构域 CD28 或者 4-1BB,临床显著改善免疫活性并提高作用持久性;第三代 CAR-T 细胞治疗相对二代增加更多刺激信号,活性更强更持久;此外四代 CAR-T细胞又被称为 TRUCK T 细胞,可以使 CAR-T 细胞在肿瘤区域分泌特定细胞因子,从而克服肿瘤免疫微环境抑制,募集并活化第二波免疫细胞产生免疫反应。
CAR-T细胞治疗构
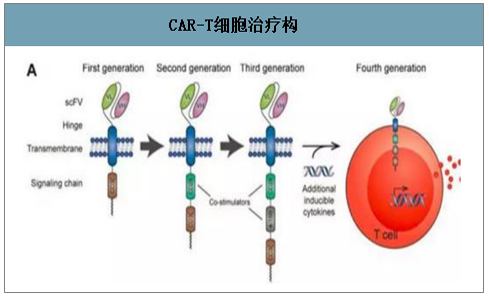
数据来源:公开资料整理
截至目前全球共有两款针对 CAR-T 疗法获批,分别是诺华的 Kymriah 和吉利德的 Yescarta,均是针对 CD19 靶点的第二代 CAR-T,新兴的第三、四代 CAR-T发展时间不长,在技术上还需要有所改进。肿瘤细胞为单克隆 B 淋巴细胞,B 细胞过度增殖导致 B 细胞慢性淋巴细胞白血病,CD19 特异性存在于大多白血病和淋巴瘤的肿瘤细胞表面,是最合适的抗原。用逆转录病毒载体将编码 CD19-CAR 的基因转染患者 T 细胞,使得 CD19-CAR 能够在细胞表面表达,帮助下 T 细胞精准杀伤肿瘤表面 B 细胞(CD19 在正常 B 细胞也有表达,因此会有 B 细胞发育不良的副作用)。
中金普华产业研究院数据显示:CAR-T 治疗目前尚在起步期,但其优异疗效已经崭露头角。以诺华的 Kymriah 为例,适应症为复发/难治性大B 细胞淋巴瘤患者,弥漫大 B 细胞淋巴瘤(DLBCL)是最为常见的非霍淋巴瘤(NHL)亚型,约占所有非霍奇金淋巴瘤病例的三分之一。此前此类疾病标准疗法为 R-CHOP 方案,Kymriah 获批主要基于 JULIET 研究的良好结果,JULIET 研究是一项全球多中心、II 期临床试验,在 2017 年 ASH 会议上便大放异彩,当时 JULIET研究更新的结果显示,Kymriah 对于 R/R-DLBCL 患者的总体有效率(ORR)达 54%,完全缓解率(CR)达 40%。
截至 2019 年 5 月全球 CAR-T 治疗临床试验登记项目 507 项,主要分布在中国和美国,占比分别为 44.2%和 36.7%,主要是针对常规治疗手段难以见效的疾病是主要的研究方向,其中组织学类型肿瘤临床试验数量位居第一,其次为免疫系统疾病、淋巴组织增生性疾病和免疫增生性疾病,CAR-T 细胞可以通过改变特定抗原靶点靶向特定类型的恶性肿瘤,扩大 CAR-T 疗法的应用范围。
CAR-T治疗领域分布
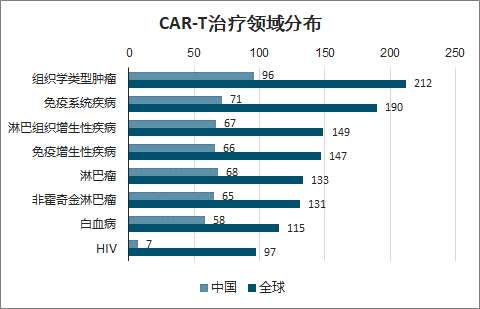
数据来源:公开资料整理
Ⅰ期临床试验数量最多;Ⅰ/Ⅱ期临床试验数量次之,Ⅱ期阶段以后试验数量锐减,说明 CAR-T 研究仍然处在相对早期,还无法大规模应用。CAR-T 治疗主要由中美引领发展,尤其是中国,临床试验数量攀升迅速,已跃居全球第一,但美国 CAR-T 治疗临床试验数量集中度明显高于中国。
目前国内还没有 CAR-T 类药物获批上市,南京传奇、恒润达生、药明巨、精准生物、斯丹赛、西比曼、华道生物、因诺免疫、普瑞金、艺妙神州、百暨基因等多家国内企业均在开展相关 CAR-T 的研究,参与玩家众多,未来竞争也将较为激烈。复星凯特益基利仑赛注射液(即抗人 CD19 CAR-T 细胞注射液)是目前国内首家且唯一已经获得上市受理的产品,用于成人复发难治性大B 细胞淋巴瘤治疗(包括弥漫性大 B 细胞淋巴瘤(DLBCL)非特指型、原发性纵隔 B 细胞淋巴瘤(PMBCL)、高级别 B 细胞淋巴瘤和滤泡淋巴瘤转化的 DLBCL),和 KYMRIAH为同一靶点药物。
目前 CAR-T 在血液性肿瘤中呈现明显疗效,但在实体瘤中受到一定限制,主要是因为实体瘤缺乏特异性肿瘤抗原,但未来实体瘤仍然是 CAR-T 研究的重点,一旦可以攻克将会给 CAR-T 市场带来更广阔的空间,能使 CAR-T治疗真正从早期走向通用,发挥“私人订制”的价值。目前全球科研工作者均致力于 CAR-T 改造和优化,通过寻找最佳肿瘤靶向、保持 T 细胞体内持久性和抵抗肿瘤微环境的免疫抑制,将更多的适应症纳入到这一突破性技术治疗中,当前已经筛选出若干有望治疗实体瘤的新型 CAR-T 疗法。
免责声明:
1、本站部分文章为转载,其目的在于传递更多信息,我们不对其准确性、完整性、及时性、有效性和适用性等作任何的陈述和保证。本文仅代表作者本人观点,并不代表本网赞同其观点和对其真实性负责。
2、中金普华产业研究院一贯高度重视知识产权保护并遵守中国各项知识产权法律。如涉及文章内容、版权等问题,我们将及时沟通与处理。